SeekSoul Tools v1.3.0
SeekSoulTools 是寻因生物开发的一套处理单细胞转录组数据的软件,目前该软件包含五个模块:
1.rna模块;用于识别细胞标签barcode,比对定量,得到可用于下游分析的细胞表达矩阵,之后进行细胞聚类和差异分析,该模块不仅支持SeekOne®系列试剂盒产出数据,还 可通过对barcode的描述,支持多种自定义设计结构;
2.fast模块:该模块专门针对SeekOne® DD单细胞全序列转录组试剂盒产出的数据,用于对数据进行barcode提取,双端reads比对,定量,以及全序列数据特有的指标统计。
3.vdj模块:该模块用于专门针对SeekOne® DD单细胞免疫分析试剂盒产出的数据,用于组装、过滤和注释免疫受体;
4.multivdj模块:该模块用于5'RNA和VDJ数据联合分析;
5.utils模块:该模块包含其他小工具。
软件下载
SeekSoul Tools v1.3.0
Download-SeekSoulTools - md5: 21b19d5f10022f0d8caf1a1a9c3f66c6
wget下载方式
wget -c -O seeksoultools.1.3.0.tar.gz "https://seekgene-public.oss-cn-beijing.aliyuncs.com/software/seeksoultools/seeksoultools.1.3.0.tar.gz"curl下载方式
curl -C - -o seeksoultools.1.3.0.tar.gz "https://seekgene-public.oss-cn-beijing.aliyuncs.com/software/seeksoultools/seeksoultools.1.3.0.tar.gz"软件安装
IMPORTANT
安装前请确保已正确配置conda环境,避免与其他生信软件环境冲突。
安装:
# 解压
tar zxf seeksoultools.1.3.0.tar.gz
cd seeksoultools.1.3.0
# 设置环境变量
export PATH=`pwd`:$PATH
echo "export PATH=$(pwd):\$PATH" >> ~/.bashrc
# 初始化和安装验证,初次执行所需时间稍长
`pwd`/seeksoultools --versionTIP
建议将PATH添加到~/.bashrc,便于后续命令行直接调用。
NOTE
若出现"command not found"或依赖报错,请检查conda环境激活及PATH设置。
使用教程
rna模块
数据准备
测试数据下载
测试数据 - md5: 3d15fcfdefc0722735d726f40ec4e324(物种:人)
wget下载方式
wget -c -O demo_dd.tar "https://seekgene-public.oss-cn-beijing.aliyuncs.com/software/data/demodata/demo_dd.tar"
# decompress
tar xf demo_dd.tarcurl下载方式
curl -C - -o demo_dd.tar "https://seekgene-public.oss-cn-beijing.aliyuncs.com/software/data/demodata/demo_dd.tar"
# decompress
tar xf demo_dd.tar参考基因组下载和构建
Download-human-reference-GRCh38 - md5: 5473213ae62ebf35326a85c8fba6cc42
Download-mouse-reference-mm10 - md5: 5c7c63701ffd7bb5e6b2b9c2b650e3c2
wget下载方式
wget -c -O GRCh38.tar.gz "https://seekgene-public.oss-cn-beijing.aliyuncs.com/software/data/reference/GRCh38.tar.gz"
# decompress
tar -zxvf GRCh38.tar.gz
wget -c -O mm10.tar.gz "https://seekgene-public.oss-cn-beijing.aliyuncs.com/software/data/reference/mm10_ensemble_102.tar.gz"
tar -zxvf mm10.tar.gzcurl下载方式
curl -C - -o GRCh38.tar.gz "https://seekgene-public.oss-cn-beijing.aliyuncs.com/software/data/reference/GRCh38.tar.gz"
# decompress
tar -zxvf GRCh38.tar.gz
curl -C - -o mm10.tar.gz "https://seekgene-public.oss-cn-beijing.aliyuncs.com/software/data/reference/mm10_ensemble_102.tar.gz"
tar -zxvf mm10.tar.gz参考基因组的构建可以参考如何构建参考基因组?
CAUTION
下载和解压参考基因组时,请确保磁盘空间充足,避免文件损坏导致后续分析失败。
运行
运行示例
示例1:基本用法
为分析设置必要的配置文件,包括样本数据的路径、试剂类型、基因组索引、GTF等。使用以下命令运行SeekSoulTools:
seeksoultools rna run \
--fq1 /path/to/demo_dd/demo_dd_S39_L001_R1_001.fastq.gz \
--fq2 /path/to/demo_dd/demo_dd_S39_L001_R2_001.fastq.gz \
--samplename demo_dd \
--genomeDir /path/to/GRCh38/star \
--gtf /path/to/GRCh38/genes/genes.gtf \
--chemistry DDV2 \
--core 4 \
--include-introns示例2:指定其他版本STAR进行分析
为了在分析中使用特定版本的STAR,并确保与该版本生成的–genomeDir兼容,你可以使用以下命令运行SeekSoulTools,并指定所需版本的STAR的路径:
seeksoultools rna run \
--fq1 /path/to/demo_dd/demo_dd_S39_L001_R1_001.fastq.gz \
--fq2 /path/to/demo_dd/demo_dd_S39_L001_R2_001.fastq.gz \
--samplename demo_dd \
--genomeDir /path/to/GRCh38/star \
--gtf /path/to/GRCh38/genes/genes.gtf \
--chemistry DDV2 \
--core 4 \
--include-introns \
--star_path /path/to/cellranger-5.0.0/lib/bin/STARNOTE
--star_path参数需与参考基因组索引版本严格对应,否则会导致比对失败。
示例3:一个样本有多组fastq数据
如果一个样本有多个FASTQ数据集,你可以在运行SeekSoulTools时提供与该样本相关的所有FASTQ文件的路径。以下是一个示例命令:
seeksoultools rna run \
--fq1 /path/to/demo_dd_S39_L001_R1_001.fastq.gz \
--fq1 /path/to/demo_dd_S39_L002_R1_001.fastq.gz \
--fq2 /path/to/demo_dd_S39_L001_R2_001.fastq.gz \
--fq2 /path/to/demo_dd_S39_L002_R2_001.fastq.gz \
--samplename demo \
--genomeDir /path/to/GRCh38/star \
--gtf /path/to/GRCh38/genes/genes.gtf \
--chemistry DDV2 \
--core 4 \
--include-introns示例4:自定义R1结构
要自定义 Read 1 (R1) FASTQ文件的结构,可以使用以下命令:
seeksoultools rna run \
--fq1 /path/to/demo_dd_S39_L001_R1_001.fastq.gz \
--fq2 /path/to/demo_dd_S39_L001_R2_001.fastq.gz \
--samplename demo \
--genomeDir /path/to/GRCh38/star \
--gtf /path/to/GRCh38/genes/genes.gtf \
--barcode /path/to/utils/CLS1.txt \
--barcode /path/to/utils/CLS2.txt \
--barcode /path/to/utils/CLS3.txt \
--linker /path/to/utils/Linker1.txt \
--linker /path/to/utils/Linker2.txt \
--structure B9L12B9L13B9U8 \
--core 4 \
--include-intronsB9L12B9L13B9U8表示read1的结构为:9个碱基barcode+12个碱基linker+9个碱基barcode+13个碱基linker+9个碱基barcode+9碱基UMI,整体cellbarcode有3段,共27个碱基(9*3),UMI为8个碱基- 使用
--barcode依次指定3段barcode,--linker依次指定2段linker。
TIP
自定义结构时,建议先用小样本测试结构参数,确保barcode/linker/UMI提取无误。
软件参数说明
| 参数 | 参数说明 |
|---|---|
| --fq1 | R1 fastq数据路径。 |
| --fq2 | R2 fastq数据路径。 |
| --samplename | 样本名称,会在outdir目录下创建以样本名称命名的目录。仅支持数字,字母和下划线。 |
| --outdir | 结果输出目录。默认值:./。 |
| --genomeDir | STAR构建的参考基因组路径, 版本需要与SeekSoulTools使用的STAR一致。 |
| --gtf | 相应物种的gtf路径。 |
| --core | 分析使用的线程数。 |
| --chemistry | 试剂类型,每种对应一组--shift、--pattern、 --structure、--barcode和--sc5p的组合,可选值:DDV2,DD5V1,MM,MM-D;DDV2 对应SeekOne(R) DD单细胞3'转录组试剂盒; DD5V1 对应SeekOne(R) DD单细胞5'转录组试剂盒; MM 对应SeekOne(R) MM单细胞转录组试剂盒; MM-D 对应SeekOne(R) MM大孔径高通量转录组试剂盒 |
| --skip_misB | barcode不允许碱基错配,默认允许一个碱基错配。 |
| --skip_misL | linker不允许碱基错配,默认允许一个碱基错配。 |
| --skip_multi | 舍弃能纠错为多个白名单barocde的reads,默认纠错为比例最高的barcode。 |
| --expectNum | 预估的捕获细胞数目。 |
| --forceCell | 当正常分析得到的细胞数⽬不理想时,选⽤此参数,后⾯加⼀个预期的数值N,SeekSoulTools软件会按照UMI从⾼到低取前N个细胞。 |
| --include-introns | 不启用时,只会选择exon reads⽤于定量;启用时,intron reads也会⽤于定量。 |
| --star_path | 指定其他版本的STAR路径进行比对,版本需要与--genomeDir版本兼容,默认的--star_path为环境下的STAR。 |
WARNING
参数设置不当(如chemistry、genomeDir、gtf等)会直接导致分析失败或结果异常,请务必核对参数含义和输入路径。
结果文件说明
以下是输出目录结构:每一行代表一个文件或文件夹,用 "├──" 表示,数字表示三个重要的输出文件。
./
├── demo_report.html 1
├── demo_summary.csv 2
├── demo_summary.json
├── step1
│ └──demo_2.fq.gz
├── step2
│ ├── featureCounts
│ │ └── demo_SortedByName.bam
│ └── STAR
│ ├── demo_Log.final.out
│ └── demo_SortedByCoordinate.bam
├── step3
│ ├── filtered_feature_bc_matrix 3
│ └── raw_feature_bc_matrix
└──step4
├── FeatureScatter.png
├── FindAllMarkers.xls
├── mito_quantile.xls
├── nCount_quantile.xls
├── nFeature_quantile.xls
├── resolution.xls
├── top10_heatmap.png
├── tsne.png
├── tsne_umi.png
├── tsne_umi.xls
├── umap.png
└── VlnPlot.png- 样本的html报告
- 样本的csv格式质控信息
- 算法判定是细胞的稀疏矩阵
NOTE
若输出目录缺失关键文件,请优先检查上游步骤是否报错,或参数设置是否正确。
处理过程
step1: barcode/UMI提取
SeekSoulTools根据不同的Read1的结构设计和参数对barcode/UMI进行提取和处理,对Read1和Read2进行过滤,输出新的fastq文件。
结构设计和描述
barcode和UMI描述 以字母和数字描述Read1的基本结构,字母描述碱基含义,数字描述碱基长度。
B: barcode部分碱基
L: linker部分碱基
U: UMI部分碱基
X: 其他任意碱基,用于占位以下面两种Read1结构为例:
B8L8B8L10B8U8:
B17U12:

错位设计的Anchor定位 MM设计下,为了增加Linker部分在测序时碱基均衡性,加入了1-4 bp的移码碱基,即anchor,anchor决定了barcode的起始位置。

数据流程
确定anchor:
对于Read1有错位设计的数据(MM试剂产出的数据),SeekSoulTools尝试在Read1序列前7个碱基中寻找anchor序列,以确定后续barcode等的起始。若没找到anchor序列,此条read以及对应的R2被认为是无效read。
Barcode和Linker矫正:
在确定barcode的起始后,根据结构设计,取出相应序列。当取出的barcode序列在白名单中时,我们认为它是有效barcode,计入有效barcode的reads数量;当barcode不在白名单中时,我们认为它是无效barcode。
测序过程中,有一定几率发生测序错误。在提供有白名单的情况下,SeekSoulTools可以尝试barcode矫正。在启用矫正时,当无效barcode一个碱基错配(一个hamming distance)的序列存在于白名单中:
- 只有唯一一个序列存在于白名单中:我们将这个无效barcode矫正为白名单中barcode;
- 有多个序列存在于白名单中:我们将这个无效barcode改为read支持数量最多的序列;
Linker的处理与Barcode相同。
接头和PolyA序列剪切
在转录组产品中,Read2的末端有可能会出现polyA tail,建库时可能引入的接头序列。我们对这些污染序列进行切除,剪切完的read2长度需要大于设定的最小长度来保证有足够的信息,准确比对到基因组的位置。如果剪切完成后的read2长度小于最小长度,我们认为这条read为无效read。
经过上述处理后,数据组成如下图:
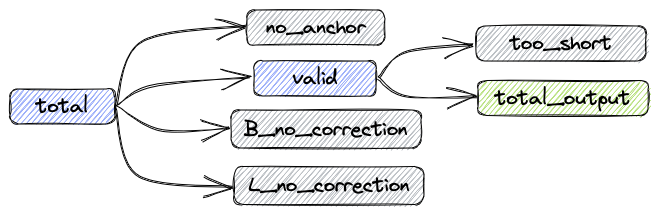
- total: 总共的reads数目
- valid: 不需要矫正和矫正成功的reads数目
- B_corrected: 矫正成功的reads数目
- B_no_correction: 错误Barcode的reads数目
- L_no_correction: 错误Linker的reads数目
- no_anchor:不包含anchor的reads数目
- trimmed: 进行过剪切的reads数目
- too_short: 进行过剪切后长度小于60bp的reads数目
指标之间的关系如下:
total = valid + no_anchor + B_no_correction + L_no_correction
输出fastq的reads数:total_output = valid - too_short
step2: 进行比对并找到比对基因
序列比对
使用STAR比对软件将处理后的R2比对到参考基因组上。
使用QualiMap软件和转录本注释文件GTF,统计reads比对外显子、内含子和基因间区等的比例。
使用featureCounts将比对上的read注释到基因上,可以选择不同的注释规则,如链方向性和定量的feature。当使用外显子定量时,当read超过50%碱基比对到外显子区域时,认为该read来源于此外显子以及外显子对应的基因;当使用转录本定量时,当read超过50%碱基比对到转录本区域时,认为该read来源于此转录本以及转录本对应的基因。
经过上述处理后,有如下数据指标:
- Reads Mapped to Genome: 比对到参考基因组上的reads占所有reads的比例(包括只有一个比对位置和多个比对位置的reads)
- Reads Mapped Confidently to Genome: 在参考基因组上只有一个比对位置的reads占所有reads的比例
- Reads Mapped to Intergenic Regions:比对到基因间隔区reads占所有reads的比例
- Reads Mapped to Intronic Regions:比对到内含子reads占所有reads的比例
- Reads Mapped to Exonic Regions:比对到外显子reads占所有reads的比例
step3: 定量
UMI定量
SeekSoulTools以barcode为单位提取featureCounts输出的bam数据,统计注释到基因的UMI和UMI对应的reads数:
- 过滤掉对应UMI为单个重复碱基的reads, 例如UMI为TTTTTTTT
- 当read注释到多个基因,在有唯一外显子的注释时,为有效read,其他情形下都过滤掉
UMI矫正
测序过程中,UMI也有一定概几率出现测序错误。SeekSoulTools默认使用UMI-tools的adjacency方法对UMI进行矫正。
 图片来源: https://umi-tools.readthedocs.io/en/latest/the_methods.html
图片来源: https://umi-tools.readthedocs.io/en/latest/the_methods.html
细胞判定
在一个细胞群中,我们认为细胞和细胞的mRNA的含量不会相差太多。如果一个barcode对应的mRNA的含量很低,我们认为这个barcode的磁珠并没有捕获细胞,mRNA来源于背景。SeekSoulTools会以上面的规则,进行barcode是否为细胞的判定。有以下几个步骤:
- 对所有barcode按照对应的UMI数由高到低排序;
- 取预估细胞的1%位置的barcode的UMI数除以10为阈值;
- barcode的UMI数大于阈值的判定为细胞;
- barocde的UMI小于阈值,但大于300时,使用DropletUtils分析。DropletUtils方法先假设UMI数量低于100的barcode为empty droplet,然后根据每个droplet相同基因的UMI数总和为背景RNA表达谱中该基因UMI数目,进而得到基因UMI数目的期望值。再通过将每个barcode的UMI数进行统计学检验,显著差异的为细胞;
- 不符合上述条件的为背景。
经过上述处理后,有如下数据指标:
- Estimated Number of Cells: 算法判定的细胞总数
- Fraction Reads in Cells: 判定为细胞的reads占所有参与定量的reads的比例
- Mean Reads per Cell: 细胞的平均reads数,总reads数/判定的细胞数
- Median Genes per Cell: 判定为细胞的barcode中基因数的中位数
- Median UMI Counts per Cell: 判定为细胞的barcode中UMI数的中位数
- Total Genes Detected: 所有细胞检测到基因数量
- Sequencing Saturation: 饱和度,1 - UMI总数/reads总数
step4: 后续分析
经过上述定量,得到表达矩阵后,我们可以进行下一步的分析。
Seurat分析流程
使用Seurat计算线粒体含量,细胞中UMI总数,细胞中基因总数。之后对矩阵进行归一化、寻找高变基因、降维聚类之后寻找差异基因。
fast模块参考fast模块
vdj模块
数据准备
测试数据下载
测试数据 - md5: afbd2deac59b581a4d44a0f73655d71d(物种:人)
wget -c -O PBMC_xin.tar "https://seekgene-public.oss-cn-beijing.aliyuncs.com/software/data/demodata/PBMC_xin.tar"
# decompress
tar xf PBMC.tarcurl -C - -o PBMC_xin.tar "https://seekgene-public.oss-cn-beijing.aliyuncs.com/software/data/demodata/PBMC_xin.tar"
# decompress
tar xf PBMC.tar运行
运行示例
示例1:T细胞受体分析示例
seeksoultools vdj run \
--fq1 /path/to/demo_tcr/demo_tcr_R1.fq.gz \
--fq2 /path/to/demo_tcr/demo_tcr_R2.fq.gz \
--samplename demo_tcr \
--chain TR \
--core 16 \
--outdir /path/to/ouput/demo_tcr \
--organism human示例2:B细胞受体分析示例
seeksoultools vdj run \
--fq1 /path/to/demo_bcr/demo_bcr_R1.fq.gz \
--fq2 /path/to/demo_bcr/demo_bcr_R2.fq.gz \
--samplename demo_bcr \
--chain IG \
--core 16 \
--outdir /path/to/ouput/demo_bcr \
--organism human软件参数说明
| 参数 | 参数说明 |
|---|---|
| --fq1 | R1 fastq数据路径。 |
| --fq2 | R2 fastq数据路径。 |
| --samplename | 样本名称。仅支持数字,字母和下划线。 |
| --organism | 物种,可选值:human,mouse |
| --chain | 链类型,可选值:IG,TR; IG对应B细胞受体; TR对应T细胞受体。 |
| --core | 分析使用的线程数。 |
| --outdir | 结果输出目录,绝对路径,并且保证每个任务的outdir唯一。 |
| --cfg | 当物种非人非鼠时,需要自行配置ref文件,记录三个ref的文件为该参数的value。 |
| --read_pair | 是否需要用paired reads去做组装,默认为False。 |
| --keep_tmp | 是否保留trust4的中间文件,默认不保存,当指定该参数时,对这些中间文件进行压缩。 |
| --matrix | rna matrix数据。如果指定该参数,则在find clone之前对vdj和matrix的barcode取交集,如果需要,请指定rna数据的filter matrix路径。 |
| --rna_wd | rna数据的分析路径,如果同时指定该参数及--matrix参数,则会生成rna和vdj联合的websumarry。指定该参数时请注意rna和vdj样本名字统一。 |
构建ref文件示例
方式一:可利用trust4软件,获取IMGT数据库并构建所需ref。
BuildImgtAnnot.pl Homo_sapien > IMGT+C.fa
grep ">" IMGT+C.fa | cut -f2 -d'>' | cut -f1 -d'*' | sort | uniq > bcr_tcr_gene_name.txt
BuildDatabaseFa.pl refdata-GRCh38/fasta/genome.fa refdata-GRCh38/genes/genes.gtf bcr_tcr_gene_name.txt > bcrtcr.fa方式二:如果genes.gtf文件中基因名称不包含所需的BCR/TCR 基因名称的话,可单独配置:
### 下载IMGT数据库所有物种序列
wget -c https://www.imgt.org/download/GENE-DB/IMGTGENEDB-ReferenceSequences.fasta-nt-WithGaps-F+ORF+inframeP
### 根据id里面的物种信息提取所需序列,并整理成trust4所需格式
from Bio import SeqIO
from Bio.SeqRecord import SeqRecord
from Bio.Seq import Seq
with open("IMGTGENEDB-ReferenceSequences.fasta-nt-WithGaps-F+ORF+inframeP", "r") as file, open('IMGT+C.fa', 'w') as out:
for record in SeqIO.parse(file, "fasta"):
#if "IG" not in record.description and "TR" not in record.description:
if 'Bos taurus_Holstein' in record.description:
new_id = record.description.strip().split('|')[1]
new_seq = record.seq.upper()
new_record = SeqRecord(Seq(new_seq), id=new_id, description="")
SeqIO.write(new_record, out, "fasta")准备leader文件
在IGMT 下载 "L-PART1+L-PART2"。
- IG 和TR 的分别下载,TR IG 分为2个文件
- IGH IGK IGL 分别下载,合并成一个文件
- TRA TRB 分别下载,合并成一个文件 将碱基转成大写:
cat IG_L-PART1+L-PART2.fa |awk '/^>/ {print; next} {printf "%s", toupper($0)}' | awk 'BEGIN{RS=">"; FS="\n"} NR>1 {print ">" $1 "\n" $2}'写入cfg文件
cfg文件格式如下:
fa:/your/path/bcrtcr.fa
ref:/your/path/IMGT+C.fa
leader:/your/path/IG_L-PART1+L-PART2.fa
- 如果是通过方式二配置的ref信息,可以fa和ref都指定IMGT+C.fa
结果文件说明
以下是输出目录结构:每一行代表一个文件或文件夹,用 "├──" 表示。
.
├── Analysis
│ ├── dandelion
│ ├── qc
│ ├── summary.json
│ └── trust4
└── Outs
├── demo_TCR_airr_rearrangement.tsv AIRR format result file
├── demo_TCR_filtered_contig_annotations.tsv Annotation results for filtered contigs
├── demo_TCR_cell_barcodes.json All barcode for filtered contigs
├── demo_TCR_clonotypes.tsv Clonotype clustering information
├── demo_TCR_consensus.fasta Consensus sequences in FASTA format per clonotype chain
├── demo_TCR_filtered_contig.fasta FASTA sequences of filtered assembled contigs
├── demo_TCR_report.html Analysis report
└── metrics_summary.csv Quality control metrics summary file处理过程
barcode/UMI提取
根据read1的结构对barcode/UMI进行提取和处理,对read1和read2进行过滤,输出新的fastq文件。
结构设计和描述
barcode和UMI描述 以字母和数字描述Read1的基本结构,字母描述碱基含义,数字描述碱基长度。
B: barcode部分碱基
U: UMI部分碱基
X: 其他任意碱基,用于占位
免疫分析产品的Read1结构为B17U12:
数据流程
Barcode识别和矫正:
根据结构设计,确定barcode所在序列位置,取出相应序列。当取出的barcode序列在白名单中时,我们认为它是有效barcode,计入有效barcode的reads数量;当barcode不在白名单中时,我们认为它是无效barcode。
测序过程中,有一定几率发生测序错误。在提供有白名单的情况下,SeekSoulTools可以尝试barcode矫正。在启用矫正时,当无效barcode一个碱基错配(一个hamming distance)的序列存在于白名单中:
- 只有唯一一个序列存在于白名单中:我们将这个无效barcode矫正为白名单中barcode;
- 有多个序列存在于白名单中:我们将这个无效barcode改为read支持数量最多的序列;
经过上述处理后,数据指标包括:
- total: 总共的reads数目
- valid: 不需要矫正和矫正成功的reads数目
- Q30 Bases in Barcode: barcode序列的q30比例
- Q30 Bases in UMI: UMI序列的q30比例
- Q30 Bases in R2 Read: reads2中q30比例
VDJ基因比例统计
根据ref构建STAR索引,并进行reads的比对,根据bam文件统计TRA、TRB、TRD或者IGK、IGL、IGH数目以及对应的比例
序列组装
1、利用trust4的fastq-extractor模块提取出可能包含TCR/BCR序列的reads,然后对每个barcode进行downsample,超过80000条reads的细胞只取前80000条reads。
2、按照barcode,过滤掉支持reads小于n50的umi,然后用umitools对umi进行矫正。
3、基于上述reads用trust4进行组装。
trust4详细说明请参考trust4
VDJ注释
利用trust4的annotator进行VDJC基因及CDR3位置的注释。对于一个细胞内一条链有多种注释的情况,选取umi数值最高的contig作为primary_chain。umi数值是根据每个contig的reads信息统计得到的,在计数之前进行一步过滤:当同一个umi被用于多个contig组装时,对这些contig按照reads降序排列,reads数目第二高的contig/最高的contig比例小于0.15时,该umi只被最高contig计数,其他不进行该umi的计数。
clonotype计算
1、挑选符合chain要求的contig; 过滤掉1-umi/reads小于0.94的contig; 过滤掉contig支持的umi之和小于3的细胞。
2、如果有提供5'matrix信息,细胞barcode取交集。
3、利用dandelion基于CDR3 氨基酸序列相似性判定克隆,相似性阈值:BCR设定85%,TCR设定100%。详细条件可参考:sc-dandelion
4、对于只包含单链的克隆型,找到与之共享VJ基因以及CDR3氨基酸序列的其他所有contig,以这些contig umi的n50的1%作为阈值,如果该单链umi小于这个阈值,则丢弃。
5、对于保留下来的单链克隆型,找到与之共享VJ基因以及CDR3氨基酸序列的所有双链克隆型,按照细胞数进行排序,如果第二大size的双链克隆型与最大size的双链克隆型细胞数目之比小于0.15,将该单链克隆型合并进最大size的双链克隆型,否则不进行合并。
6、按照新的克隆型,根据细胞数排序,生成新的clone id,并给出exact id。
multivdj模块
本模块可以对5'RNA和VDJ数据进行联合分析。
运行示例
seeksoultools multivdj run \
--rnafq1 /path/to/demo/rna.demo.R1.fq.gz \
--rnafq2 /path/to/demo/rna.demo.R2.fq.gz \
--tcrfq1 /path/to/demo/tcr.demo.R1.fq.gz \
--tcrfq2 /path/to/demo/tcr.demo.R2.fq.gz \
--samplename demo_multi \
--organism human \
--core 8 \
--genomeDir /path/to/GRCh38/star \
--gtf /path/to/GRCh38/genes/genes.gtf \
--include-introns \
--outdir ./软件参数说明
| 参数 | 参数说明 |
|---|---|
| --rnafq1 | 输入的RNA数据的fq1文件。必填 |
| --rnafq2 | 输入的RNA数据的fq2文件。必填 |
| --tcrfq1 | 输入的TCR数据的fq1文件。选填 |
| --tcrfq2 | 输入的TCR数据的fq2文件。选填 |
| --bcrfq1 | 输入的BCR数据的fq1文件。选填 |
| --bcrfq2 | 输入的BCR数据的fq2文件。选填。请注意--tcrfq和--bcrfq至少一组,即可以是tcrfq1和tcrfq2,也可以是bcrfq1和bcrfq2,也可以是四个参数均指定。 |
| --samplename | 样本名称, 会在outdir目录下创建以样本名称命名的目录 |
| --organism | 物种信息,可选[human, mouse] |
| --cfg | 当物种非人非鼠时,需要自行配置ref文件,记录三个ref的文件为该参数的value。 |
| --core | 线程数 |
| --genomeDir | STAR构建的参考基因组路径, 版本需要与SeekSoulTools使用的STAR一致。 |
| --gtf | 相应基因组的gtf路径。 |
| --include-introns | 不启用时,只会选择exon reads⽤于定量;启用时,intron reads也会⽤于定量 |
| --start_path | 指定其他版本的STAR路径进行比对,版本需要与--genomeDir版本兼容,默认的--star_path为环境下的STAR。 |
utils模块
addtag
对bam进行修改,添加barcode和umi标签。
运行示例
为分析设置必要的配置文件,包括样本的bam文件和step3目录下的umi.xls文件。使用以下命令运行SeekSoulTools:
seeksoultools utils addtag \
--inbam step2/featureCounts/Samplename_SortedByName.bam \
--umifile step3/umi.xls \
--outbam Samplename_addtag.bam软件参数说明
| 参数 | 参数说明 |
|---|---|
| --inbam | 输入的bam,step2 featureCount目录下的bam文件。 |
| --outbam | addtag之后的bam文件名称 |
| --umifile | 输入的umi文件,seeksoultools输出目录step3的umi.xls文件 |
常见问题
如何构建参考基因组?
参考基因组的构建请参考如何构建参考基因组?。
chemistry 如何选择?
chemistry参数的设定跟所用试剂类型相关,比如全序列和FFPE产品选择DD-Q,DD单细胞3'转录组试剂盒请选择DD—V2, DD单细胞5'转录组试剂盒选择DD5V1等。如果chemistry参数选择错误可直接在log日志中查找"valid barcode rate of"相关信息,后面的比例太低则表示chemistry不正确。或者在samplename_summary.json文件中可查看valid 和total的比例。
fastq.gz文件有问题。
软件报错"Error while decompressing extra concatenatedgzip files on *fastq.gz\n"? 根据提示,输出的fq文件应该是不完成的,请核对参数--fq1 --fq2参数的文件是否完整。同样是fq数据不完整,也可能出现如下错误信息"FileFormatError: Error in sequence file at unknown line: Reads are improperly paired. There are more reads in file 1 than in file 2." 或者"Error in FASTQ file at line 4: Premature end of file encountered. The incomplete final record was: '@A01565:134:HKFGNDSX3:1:1101:11080:2957 1:N:0:CACTTCGA+ACAGCTGC\nCCATCACTACGGAAGGTTGAGCTCTATGATTTTTTTTTTTTTTTTTTTTTTTTTTTTTTTTTTTTTTGAAACCGCGATTTCCTTATTATTGTTAATACCCACCATTTTTAATCCAACCCCCCCGGGATTATTATCCTTAATATTATTATT\n+\n' err!!!",总而言之,请一定确保自己的fq文件是完整且配对的。
没有barcodes.tsv.gz文件。
软件报错"No such file or directory: '/outputpath/samplename/step3/filtered_feature_bc_matrix/barcodes.tsv.gz'" ? 首先查看输出目录,如果有raw_feature_bc_matrix,并且该目录下的三个文件大小没有异常小,此时可以单独运行一个细胞判定的脚本Rscript /path/seeksoultools/lib/python3.XX/site-packages/seeksoultools/utils/cell_identify.R -i outputpath/step3/raw_feature_bc_matrix -e 3000(该命令在日志中有输出) ,当执行此脚本时应该会出现报错信息,比如缺少某个R包的问题,此时请确认,1.2.1版本之前的,在脚本执行的时候先激活环境,比如请执行 source activate seeksoultools,或者export PATH=/path/seeksoultools/bin:$PATH,激活环境后重新运行脚本。另外温馨提示,在安装seeksoultools软件时不要把它软链到另一个磁盘等,请直接安装,并且保证环境名称是唯一的,在运行脚本的时候使用绝对路径。
如果检查输出目录中raw_feature_bc_matrix目录下的文件大小异常小,比如只有几个字节大小,此时可能是gtf文件有问题。具体的gtf格式说明及要求,可以参考{ref}ref-label。
samtools报错
软件报错"stderr: samtools sort: failed to read header from '/outputpath/samplename/.test/test_1M_Aligned.out.bam'"? 根据提示bam文件有问题,此时请查看/outputpath/samplename/.test/test_1M_Log.out。文件可能会提示'FATAL INPUT ERROR: unrecognized parameter name "genomeType" in input "genomeParameters.txt"',或者'EXITING because of FATAL ERROR: Genome version: 2.7.1a is INCOMPATIBLE with running STAR version: 2.7.10a SOLUTION: please re-generate genome from scratch with running version of STAR, or with version: 2.7.4a'也会提示索引的版本和STAR软件的版本。报错原因是二者版本不一致,请给软件传递参数--star_path 给定构建索引用的STAR软件路径。
用1.2.2版本seeksoultools分析完数据得到的web summary中线粒体比例都是0?
seeksoultools是根据gtf中gene_name的value中是否以Mt- 或者mt- 开头来判断线粒体基因的,如果gtf中gene_name的value没有进行这种修改就会导致报告中mt比例均为0.
"rnaseq_qc_results.txt"文件没有?
软件报错"No such file or directory: '/outputpath/samplename/step2/STAR/rnaseq_qc_results.txt'" 根据提示,软件在qualimap步骤运行失败,对于1.2.1及其之前的版本,需要在下载完软件包之后进行unpack。具体操作方式为:"source ./bin/activate ; ./bin/conda-unpack"
biotype的问题
软件运行报错"gene_biotype = re.search(r'(gene_type|gene_biotype|transcript_biotype|transcript_type) "(.*?)";', ids).group(2) AttributeError: 'NoneType' object has no attribute 'group'" 在1.2.1及其之前版本fast模块要求gtf文件的attribute列中有记录gene的biotype,当出现这个提示的时候,可以修改gtf文件,确保gene有biotype,或者可以用1.2.2及其之后的版本,当读取不到基因的biotype是,默认type为"undefine"。
关注的某个基因,最后矩阵中为什么表达量都是0?
在进行定量的时候,如果某条reads即比对到A基因又比对到B基因,在1.2.0之前的版本是直接丢掉,1.2.0及其之后的版本会对基因的位置做进一步判定,如果只有某个基因比对到的是exon区间,其他基因比对的是非exon区间,则将该reads判定给该基因。进行排查时,首先从step2/featureCounts/*_SortedByName.bam里面提取出'XT'tag中包含该基因(ensemble id 而非symbol)的reads,然后针对这些reads逐条检查,是不是XTtag中包含的多个基因,且目标基因比对的区域非exon或者XTtag包含的基因中有多个是比对的exon区域。
Too many open files
报错显示Failed to open file "/path/samplename_SortedByCoordinate.bam.tmp.1020.bam": Too many open files。该错误一般发生在samtools sort命令。可以用ulimit -n查看当前系统允许每个进程打开的最大文件,可以通过ulimit -n 8000来增大可打开文件数量。如果用户没有权限修改,则可以尝试减小线程和增大内存,比如设置-@ 1 -m 3G
qualimap文件没有生成
在运行日志最后显示"Starting BAM file analysis",没有其他错误提示。在outdir目录中只有.test文件夹,没有预期的step1 step2等。该错误发生在qualimap步骤,可查看运行日志前面,应该会有"WARNING: out of memory! Qualimap allows to set RAM size using special argument: --java-mem-size Check more details using --help command or read the manual."提示。可以通过修改
发布说明
v1.3.0
- 更新vdj模块的算法
- 统一了输出路径名称
- fast和ffpe模块去掉reads1umi后17bp低质量碱基
v1.2.2
- 添加vdj分析模块
- fast模块对FFPE样本的支持
- 修复gtf中没有lncRNA类型引起基因中位数的统计错误
- 解决基因名称重复导致差异基因缺失EnsemblID的问题
- 其他改进,提升易用性
v1.2.1
- 更新报告样式
- 增加SP1、SP2和TSO和接头的剪切
- 增加对bam添加addtag的工具
- 增强对非标准gtf的支持
- fast模块支持人和鼠之外的物种
v1.2.0
- 增加去除barcode和umi序列后的read1的fq文件输出
- 添加fast分析模块
- 应用UMI-tools的矫正方法
- 更新read注释到多个基因时的处理规则:在有唯一外显子的注释时,视为有效read
v1.0.0
- 首次发布
